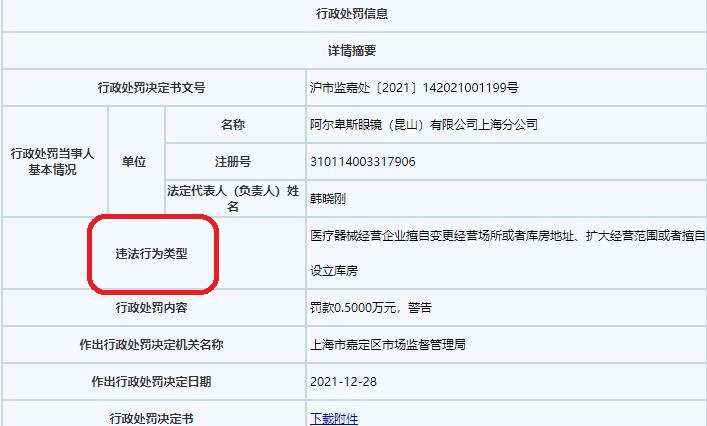
中国经济网北京1月12日讯 上海市市场监督管理局网站日前公布的行政处罚决定书(沪市监嘉处〔2021〕142021001199号)显示,阿尔卑斯眼镜(昆山)有限公司上海分公司存在医疗器械经营企业擅自变更经营场所或者库房地址、扩大经营范围或者擅自设立库房的违法行为,上海市嘉定区市场监督管理局对其罚款5000元,警告。
经查,当事人阿尔卑斯眼镜(昆山)有限公司上海分公司于2018年11月19日取得《医疗器械经营许可证》,主要从事第三类医疗器械软性角膜接触镜及护理液的零售经营活动。2021年3月15日,当事人总公司阿尔卑斯眼镜(昆山)有限公司与上海宝龙康骏房地产开发有限公司签订了《商铺租赁合同》后,于2021年4月25日办理了营业执照登记事项变更,此后又于2021年5月搬离原经营场所,开始在新址开展经营活动。至2021年8月20日执法人员开展监督检查当日,当事人变更《医疗器械经营许可证》中的许可事项经营场所未经核准,属擅自变更。
另查,当事人于2021年7月23日和2021年8月16日销售的“软性亲水接触镜”、“隐形眼镜多功能护理液”,属于第三类医疗器械产品,当事人未按要求执行医疗器械进货查验记录制度和销售记录制度,所营医疗器械无法达到可追溯的要求。
当事人擅自变更许可事项经营场所的行为,违反了《医疗器械经营监督管理办法》第十七条规定,依据《医疗器械经营监督管理办法》第五十四条、《中华人民共和国行政处罚法》第三十二条规定,上海市嘉定区市场监督管理局责令当事人改正,并罚款人民币5000元整。当事人未执行医疗器械进货查验记录制度和销售记录制度的行为,违反了《医疗器械监督管理条例》第四十五条规定,依据《医疗器械监督管理条例》第八十九条规定,上海市嘉定区市场监督管理局对其警告。
《医疗器械经营监督管理办法》第十七条规定:许可事项变更的,应当向原发证部门提出《医疗器械经营许可证》变更申请,并提交本办法第八条规定中涉及变更内容的有关资料。
跨行政区域设置库房的,应当向库房所在地设区的市级食品药品监督管理部门办理备案。
原发证部门应当自收到变更申请之日起15个工作日内进行审核,并作出准予变更或者不予变更的决定;需要按照医疗器械经营质量管理规范的要求开展现场核查的,自收到变更申请之日起30个工作日内作出准予变更或者不予变更的决定。不予变更的,应当书面说明理由并告知申请人。变更后的《医疗器械经营许可证》编号和有效期限不变。
《医疗器械经营监督管理办法》第五十四条规定:有下列情形之一的,由县级以上食品药品监督管理部门责令改正,处1万元以上3万元以下罚款:
(一)医疗器械经营企业经营条件发生变化,不再符合医疗器械经营质量管理规范要求,未按照规定进行整改的;
(二)医疗器械经营企业擅自变更经营场所或者库房地址、扩大经营范围或者擅自设立库房的;
(三)从事医疗器械批发业务的经营企业销售给不具有资质的经营企业或者使用单位的;
(四)医疗器械经营企业从不具有资质的生产、经营企业购进医疗器械的。
《中华人民共和国行政处罚法》第三十二条规定:当事人有下列情形之一,应当从轻或者减轻行政处罚:
(一)主动消除或者减轻违法行为危害后果的;
(二)受他人胁迫或者诱骗实施违法行为的;
(三)主动供述行政机关尚未掌握的违法行为的;
(四)配合行政机关查处违法行为有立功表现的;
(五)法律、法规、规章规定其他应当从轻或者减轻行政处罚的。
《医疗器械监督管理条例》第四十五条规定:医疗器械经营企业、使用单位应当从具备合法资质的医疗器械注册人、备案人、生产经营企业购进医疗器械。购进医疗器械时,应当查验供货者的资质和医疗器械的合格证明文件,建立进货查验记录制度。从事第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业,还应当建立销售记录制度。
记录事项包括:
(一)医疗器械的名称、型号、规格、数量;
(二)医疗器械的生产批号、使用期限或者失效日期、销售日期;
(三)医疗器械注册人、备案人和受托生产企业的名称;
(四)供货者或者购货者的名称、地址以及联系方式;
(五)相关许可证明文件编号等。
进货查验记录和销售记录应当真实、准确、完整和可追溯,并按照国务院药品监督管理部门规定的期限予以保存。国家鼓励采用先进技术手段进行记录。
《医疗器械监督管理条例》第八十九条规定:有下列情形之一的,由负责药品监督管理的部门和卫生主管部门依据各自职责责令改正,给予警告;拒不改正的,处1万元以上10万元以下罚款;情节严重的,责令停产停业,直至由原发证部门吊销医疗器械注册证、医疗器械生产许可证、医疗器械经营许可证,对违法单位的法定代表人、主要负责人、直接负责的主管人员和其他责任人员处1万元以上3万元以下罚款:
(一)未按照要求提交质量管理体系自查报告;
(二)从不具备合法资质的供货者购进医疗器械;
(三)医疗器械经营企业、使用单位未依照本条例规定建立并执行医疗器械进货查验记录制度;
(四)从事第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业未依照本条例规定建立并执行销售记录制度;
(五)医疗器械注册人、备案人、生产经营企业、使用单位未依照本条例规定开展医疗器械不良事件监测,未按照要求报告不良事件,或者对医疗器械不良事件监测技术机构、负责药品监督管理的部门、卫生主管部门开展的不良事件调查不予配合;
(六)医疗器械注册人、备案人未按照规定制定上市后研究和风险管控计划并保证有效实施;
(七)医疗器械注册人、备案人未按照规定建立并执行产品追溯制度;
(八)医疗器械注册人、备案人、经营企业从事医疗器械网络销售未按照规定告知负责药品监督管理的部门;
(九)对需要定期检查、检验、校准、保养、维护的医疗器械,医疗器械使用单位未按照产品说明书要求进行检查、检验、校准、保养、维护并予以记录,及时进行分析、评估,确保医疗器械处于良好状态;
(十)医疗器械使用单位未妥善保存购入第三类医疗器械的原始资料。
以下为原文: