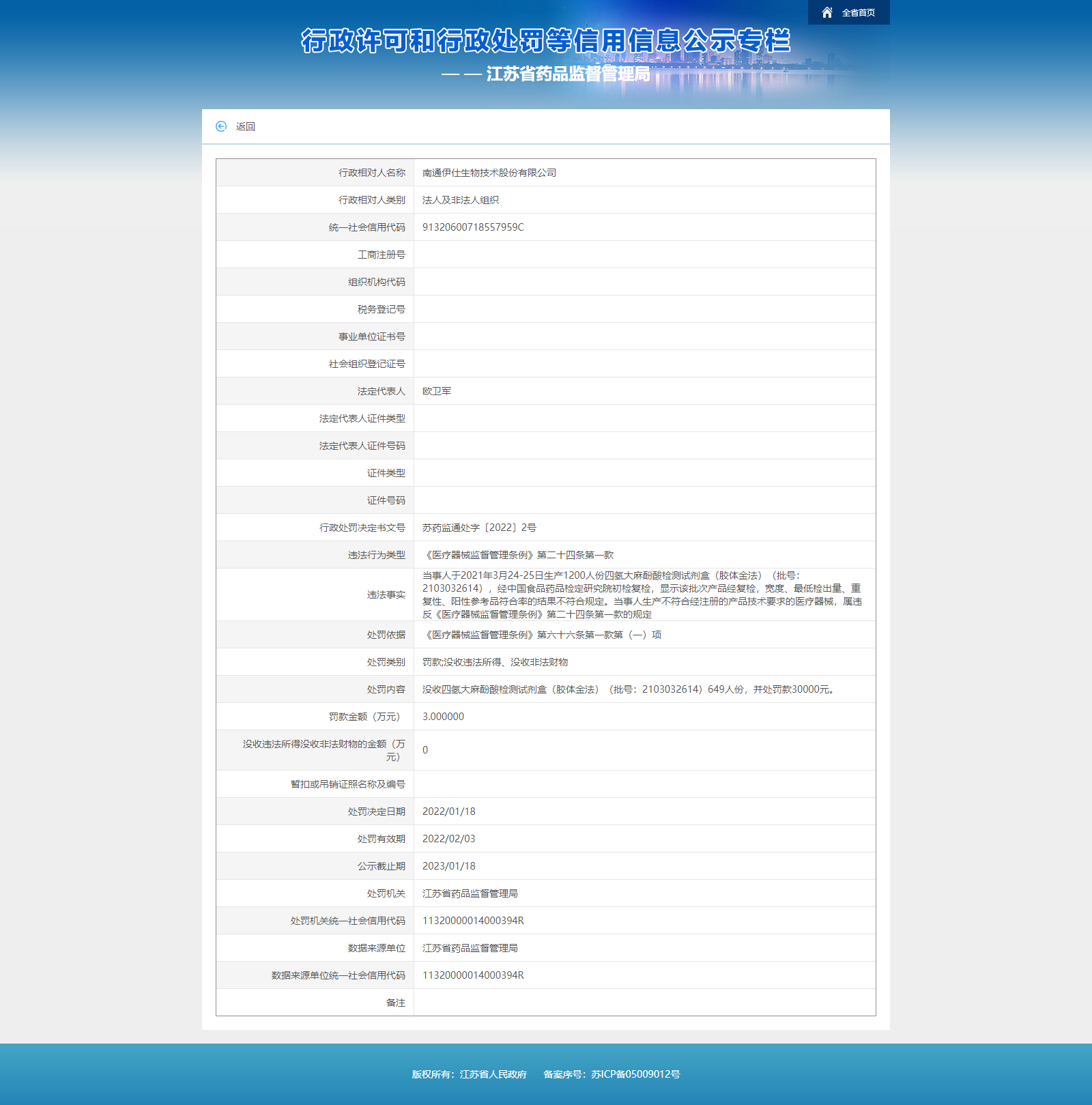
中国经济网北京1月24日讯 近日,江苏省药品监督管理局发布行政处罚决定书(苏药监通处字〔2022〕2号)。南通伊仕生物技术股份有限公司存在以下违法事实:当事人于2021年3月24-25日生产1200人份四氢大麻酚酸检测试剂盒(胶体金法)(批号:2103032614),经中国食品药品检定研究院初检复检,显示该批次产品经复检,宽度、最低检出量、重复性、阳性参考品符合率的结果不符合规定。
当事人生产不符合经注册的产品技术要求的医疗器械,属违反《医疗器械监督管理条例》第二十四条第一款的规定,根据《医疗器械监督管理条例》第六十六条第一款第(一)项的规定,江苏省药品监督管理局决定没收四氢大麻酚酸检测试剂盒(胶体金法)(批号:2103032614)649人份,并处罚款30000元。
伊仕生物是集生物原料开发、诊断试剂制造、国内外贸易于一体的综合性生物技术公司,是江苏省高新技术企业。公司位于江苏省南通经济技术开发区,毗邻中国上海。北京科卫临床诊断试剂有限公司、南通伊仕检测设备有限公司为伊士生物的全资子公司。
《医疗器械监督管理条例》第二十四条规定:医疗器械产品注册、备案,应当进行临床评价;但是符合下列情形之一,可以免于进行临床评价:
(一)工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;
(二)其他通过非临床评价能够证明该医疗器械安全、有效的。
国务院药品监督管理部门应当制定医疗器械临床评价指南。
《医疗器械监督管理条例》第六十六条规定:有下列情形之一的,医疗器械注册人、备案人应当主动开展已上市医疗器械再评价:
(一)根据科学研究的发展,对医疗器械的安全、有效有认识上的改变;
(二)医疗器械不良事件监测、评估结果表明医疗器械可能存在缺陷;
(三)国务院药品监督管理部门规定的其他情形。
医疗器械注册人、备案人应当根据再评价结果,采取相应控制措施,对已上市医疗器械进行改进,并按照规定进行注册变更或者备案变更。再评价结果表明已上市医疗器械不能保证安全、有效的,医疗器械注册人、备案人应当主动申请注销医疗器械注册证或者取消备案;医疗器械注册人、备案人未申请注销医疗器械注册证或者取消备案的,由负责药品监督管理的部门注销医疗器械注册证或者取消备案。
省级以上人民政府药品监督管理部门根据医疗器械不良事件监测、评估等情况,对已上市医疗器械开展再评价。再评价结果表明已上市医疗器械不能保证安全、有效的,应当注销医疗器械注册证或者取消备案。
负责药品监督管理的部门应当向社会及时公布注销医疗器械注册证和取消备案情况。被注销医疗器械注册证或者取消备案的医疗器械不得继续生产、进口、经营、使用。
以下为原文: