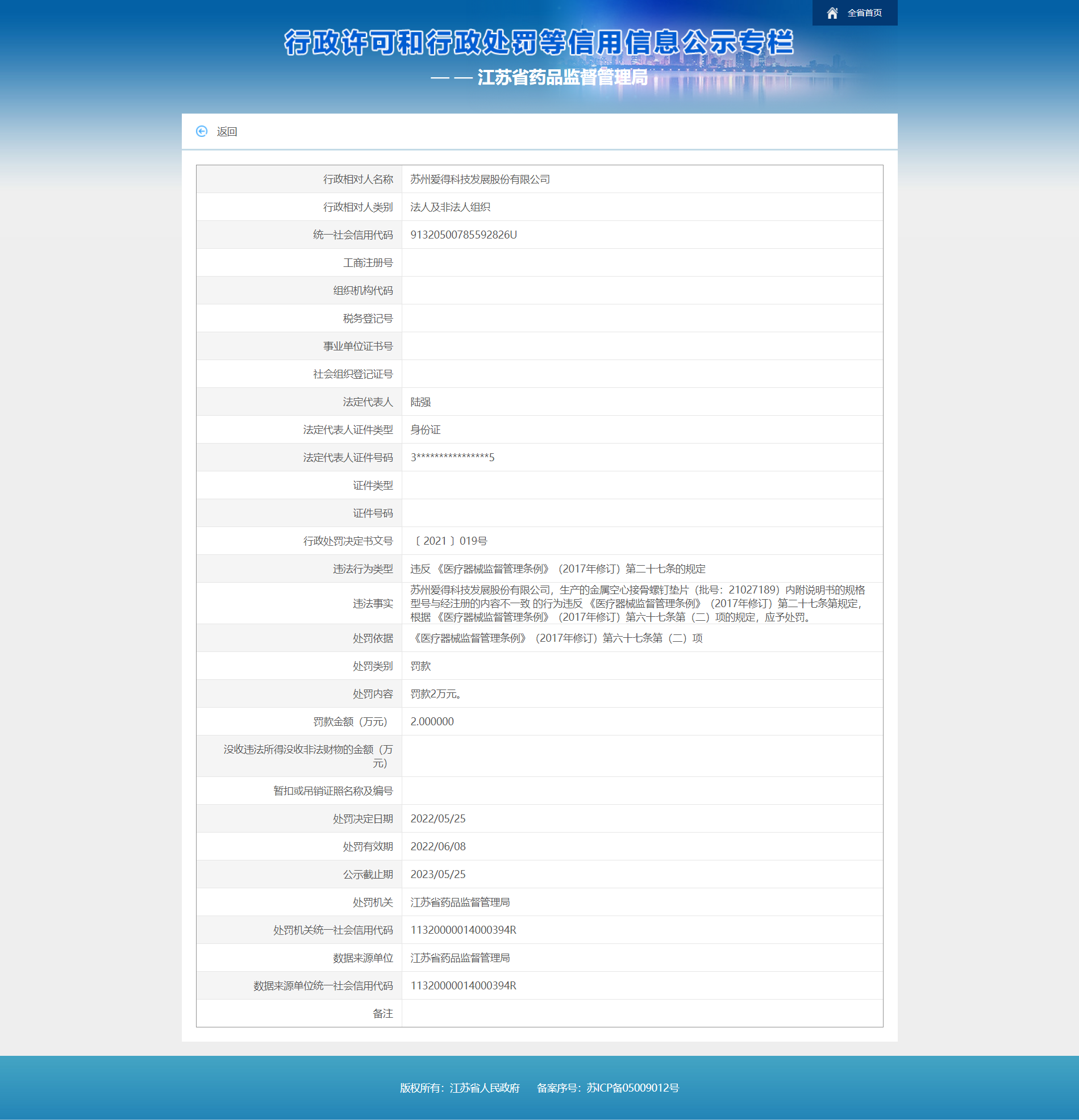
中国经济网北京5月27日讯 近日,江苏省药品监督管理局发布行政处罚决定书(〔2021〕019号)。苏州爱得科技发展股份有限公司存在以下违法事实:其生产的金属空心接骨螺钉垫片(批号:21027189)内附说明书的规格型号与经注册的内容不一致的行为违反《医疗器械监督管理条例》(2017年修订)第二十七条的规定,根据《医疗器械监督管理条例》(2017年修订)第六十七条第(二)项的规定,应予处罚。江苏省药品监督管理局对其处以罚款2万元。
爱得科技官网显示,苏州爱得科技发展股份有限公司创立于2006年,总部位于长江之滨江苏省张家港市医疗器械产业园。2019年公司引入战略投资方国药资本、毅达资本及嘉乐资本,现有注册资金8976.57万元。爱得科技是一家专注于骨科医疗器械行业的创伤、脊柱、护创解决方案专业提供商。公司主要产品包括椎体成形系统、骨科内、外固定系统、创面敷料系统、负压引流护创系统、脉冲冲洗系统及骨科动力系统等产品,并相继取得了SFDA注册证书、ISO13485、欧盟CE认证等国内外权威认证证书。
《医疗器械监督管理条例》(2017年修订)第二十七条规定:第三类医疗器械临床试验对人体具有较高风险的,应当经国务院药品监督管理部门批准。国务院药品监督管理部门审批临床试验,应当对拟承担医疗器械临床试验的机构的设备、专业人员等条件,该医疗器械的风险程度,临床试验实施方案,临床受益与风险对比分析报告等进行综合分析,并自受理申请之日起60个工作日内作出决定并通知临床试验申办者。逾期未通知的,视为同意。准予开展临床试验的,应当通报临床试验机构所在地省、自治区、直辖市人民政府药品监督管理部门和卫生主管部门。
临床试验对人体具有较高风险的第三类医疗器械目录由国务院药品监督管理部门制定、调整并公布。
《医疗器械监督管理条例》(2017年修订)第六十七条规定:医疗器械注册人、备案人发现生产的医疗器械不符合强制性标准、经注册或者备案的产品技术要求,或者存在其他缺陷的,应当立即停止生产,通知相关经营企业、使用单位和消费者停止经营和使用,召回已经上市销售的医疗器械,采取补救、销毁等措施,记录相关情况,发布相关信息,并将医疗器械召回和处理情况向负责药品监督管理的部门和卫生主管部门报告。
医疗器械受托生产企业、经营企业发现生产、经营的医疗器械存在前款规定情形的,应当立即停止生产、经营,通知医疗器械注册人、备案人,并记录停止生产、经营和通知情况。医疗器械注册人、备案人认为属于依照前款规定需要召回的医疗器械,应当立即召回。
医疗器械注册人、备案人、受托生产企业、经营企业未依照本条规定实施召回或者停止生产、经营的,负责药品监督管理的部门可以责令其召回或者停止生产、经营。
以下为原文: